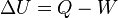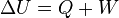Las leyes Energéticas y la vida
Investiga lo siguiente:
1)Materia y Energía
Se llama materia a todo aquello que tiene dimensiones, presenta inercia y origina gravitación. Veamos con más detalle estas propiedades básicas de la materia:
Dimensiones: ocupa un lugar en el espacio
Inercia: resistencia que opone la materia a modificar su estado de reposo o de movimiento
Gravedad o gravitación: es la atracción que actúa siempre entre objetos materiales aunque estén separados por grandes distancias. La gravedad por ejemplo es la responsable de que los objetos caigan al suelo y no se queden suspendidos flotando
La Materia es todo aquello que tiene masa y ocupa un lugar en el espacio.
Las transformaciones de la Energía tienen lugar en la alimentación de los seres vivos, en la dinámica de nuestra atmósfera y en la evolución del Universo.
Todos los procesos naturales que acontecen en la materia pueden describirse en función de las transformaciones energéticas que tienen lugar en ella.
2)Formas de energía potencial y cinética
La energía potencial, es la energía que mide la capacidad que tiene dicho sistema para realizar un trabajo en función exclusivamente de su posición o configuración. Puede pensarse como la energía almacenada en el sistema, o como una medida del trabajo. La energía potencial puede presentarse como energía potencial gravitatoria, energía potencial electrostática, y energía potencial elástica.
Más rigurosamente, la energía potencial es una magnitud escalar asociada a un campo de fuerzas (o como en elasticidad un campo tensorial de tensiones). Cuando la energía potencial está asociada a un campo de fuerzas, la diferencia entre los valores del campo en dos puntos A y B es igual al trabajo realizado por la fuerza para cualquier recorrido entre B y A.
La energía cinética de un cuerpo es aquella energía que posee debido a su movimiento. Se define como el trabajo necesario para acelerar un cuerpo de una masa determinada desde el reposo hasta la velocidad indicada. Una vez conseguida esta energía durante la aceleración, el cuerpo mantiene su energía cinética salvo que cambie su velocidad. Para que el cuerpo regrese a su estado de reposo se requiere un trabajo negativo de la misma magnitud que su energía cinética. La energía cinética se puede definir como el trabajo necesario para acelerar un cuerpo de una masa determinada desde el reposo hasta la velocidad indicada
3)1º Ley de la termodinámica
La primera ley de la termodinámica establece que la energía no se crea, ni se destruye, sino que se conserva. Entonces esta ley expresa que, cuando un sistema es sometido a un ciclo termodinámico, el calor cedido por el sistema será igual al trabajo recibido por el mismo, y viceversa.
Es decir Q = W, en que Q es el calor suministrado por el sistema al medio ambiente y W el trabajo realizado por el medio ambiente al sistema durante el ciclo
Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Leonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Clausius y Lord Kelvin para formular, de una manera matemática, las bases de la termodinámica.
La ecuación general de la conservación de la energía es la siguiente:

Que aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de la forma:
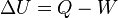
Donde U es la energía interna del sistema (aislado), Q es la cantidad de calor aportado al sistema y W es el trabajo realizado por el sistema.
Esta última expresión es igual de frecuente encontrarla en la forma 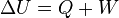 . Ambas expresiones, aparentemente contradictorias, son correctas y su diferencia está en que se aplique el convenio de signos IUPAC o el Tradicional
. Ambas expresiones, aparentemente contradictorias, son correctas y su diferencia está en que se aplique el convenio de signos IUPAC o el Tradicional
4)2º Ley de la termodinámica
Esta ley marca la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, dice algo así como que una mancha de tinta dispersada en el agua no puede volver a concentrarse en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo a otro sin pérdidas. De esta forma, la segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta solo el primer principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropia, de tal manera que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropia siempre debe ser mayor que cero.
Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un equilibrio térmico.
La aplicación más conocida es la de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de calor de una fuente o foco caliente, para ceder parte de este calor a la fuente o foco o sumidero frío. La diferencia entre los dos calores tiene su equivalente en el trabajo mecánico obtenido.
Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin.
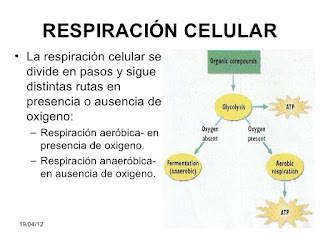
5)Flujo de Energía Biológica
El flujo de energía (como la del sol) es aprovechado por los productores primarios u organismos de compuestos orgánicos que, a su vez, utilizarán los consumidores primarios o herbívoros, de los cuales se alimentarán los consumidores secundarios o carnívoros.
De los cadáveres de todos los grupos, los des-componedores podrán obtener la energía para lograr subsistir. De esta forma se obtendrá un flujo de energía unidireccional en el cual la energía pasa de un nivel a otro en un solo sentido y siempre con una pérdida en forma de calor.
Para que un ecosistema pueda funcionar, necesita de un aporte energético que llega a la biosfera en forma, principalmente de energía lumínica, la cual proviene del Sol y a la que se le llama comúnmente flujo de energía(algunos sistemas marinos excepcionales no obtienen energía del sol sino de fuentes hidrotermales.
6)Sistemas Abiertos y Cerrados
Los sistemas termodinámicos pueden ser aislados,cerrados o abiertos.
Sistema aislado: es aquél que no intercambia ni materia ni energía con los alrededores.
Sistema cerrado: es aquél que intercambia energía (calor y trabajo ) pero no materia con los alrededores (su masa permanece constante).
Sistema abierto: es aquél que intercambia energía y materia con los alrededores.
En la siguiente figura se han representado los distintos tipos de sistemas termodinámicos.
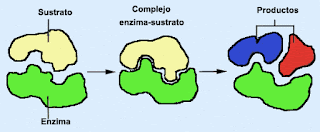
7)Enzimas
Son moléculas de naturaleza proteica y estructural que catalizan reacciones químicas, siempre que sean termodinamicamente posibles: una enzima hace que una reacción química que es energéticamente posible pero que transcurre a una velocidad muy baja, sea cinética mente favorable, es decir, transcurra a mayor velocidad que sin la presencia de la enzima.En estas reacciones, las enzimas actúan sobre unas moléculas denominadas sustratos, las cuales se convierten en moléculas diferentes denominadas productos. Casi todos los procesos en las células necesitan enzimas para que ocurran a unas tasas significativas. A las reacciones mediadas por enzimas se las denomina reacciones enzimáticas.
8)Catalizadores
Un catalizador es aquello que permite desarrollar un proceso de transformación de tipo catalítico .
Para entender el concepto, por lo tanto, debemos saber qué es la catalisis . Este vocablo que deriva del griego refiere a los cambios químicos que se generan a causa de sustancias que no sufren modificaciones durante el transcurso de una reacción.
Para la química, por lo tanto, un catalizador es una clase de sustancia que, durante la catálisis, altera el desarrollo de una reacción. Los catalizadores que incrementan la velocidad de la reacción reciben el nombre de catalizador positivo, mientras que aquellos que ocasionan una disminución de la velocidad se califican como catalizadores negativos.
9)Función de las Enzimas
Las enzimas son proteínas globulares que actúan como biocatalizadores, es decir, aceleran las reacciones químicas en los seres vivos sin modificarse. Al acelerarse las reacciones, disminuye la energía de activación y tiempo de reacción
10)Factores que modifican la velocidad de las reacciones
químicas
. Factores que afectan la velocidad de una reacción química.
1. Naturaleza de los reactivos.
2. Concentración de los reactivos
3. Temperatura
4. Catalizadores
1. La naturaleza de los reactivos
Se refiere a que la velocidad de una reacción química varía según la reactividad de las sustancias, es decir de la habilidad para romper los enlaces existentes para formar nuevos enlaces. Por lo que algunas reacciones son rápidas y otras son lentas.
2. Concentración de los reactivos Conforme aumenta la concentración, un mayor número de moléculas de un reactivo entran en contacto con las moléculas de otro reactivo y se forman más moléculas de producto.
3. Temperatura Al aumentar la temperatura de una reacción, aumenta la cantidad de moléculas de reactivo que tiene suficiente energía para reaccionar, por esta razón la velocidad de la reacción aumenta.
4. Catalizador. tambien modifica la velocidad de reacción.Definimos catalizador como una sustancia que acelera o retarda la velocidad de una reacción química, la cual al final se recupera sin que haya sufrido un cambio apreciable .

Integrantes: Prof:Asdrubal Carrion
Julieth Valderrama 4to año "U"
Dugleiner Yepez
Marisnel Garcia
Juan C. Avila
Luis M. Valderrama
Estefani Abreu